防疫物資出口 防護服出口需要哪些證件資質?
2020-06-29 14:51:15
Landbridge平臺
先了解一下出口資質
國內出口貿易企業需具備的資質和材料:
1.營業執照(經營范圍有相關經營內容)。
2.企業生產許可證(生產企業)。
3.產品檢驗報告(生產企業)。
4.醫療器械注冊證(非醫用不需要)。
5.產品說明書(跟著產品提供)、標簽(隨附產品提供)。
6.產品批次/號(外包裝)。
7.產品質量安全書或合格證(跟著產品提供)。
8.產品樣品圖片及外包裝圖片。
9.貿易公司須取得海關收發貨人注冊備案。
國內生產企業出口資質證明
生產醫用防護服用于出口,中國海關不需要企業提供相關資質證明文件,但一般進口國會要求生產企業提供產品三證,以證明該進口的商品在中國已合法上市,具體如下:
1.營業執照(經營范圍包含有醫療器械相關)。
2.醫療器械產品備案證或者注冊證。
3. 廠家檢測報告。
生產企業有進出口權,可以自行出口,如沒有進出口權,可以通過外貿代理進行出口銷售。
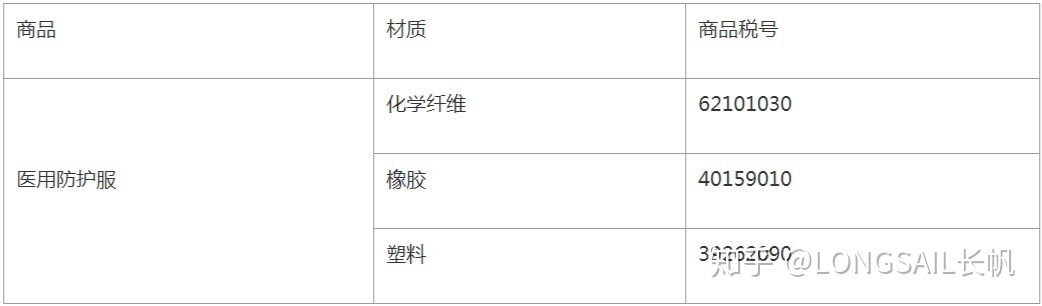
商品歸類
除特殊情況外,絕大部分防護服按照材質分類應歸入下列稅號:
禁限管理
目前商務部未對防護服設置貿易管制要求,中國海關也無針對防護服物資的監管證件口岸驗核要求。
出口退稅
防護服的出口退稅率為13%。
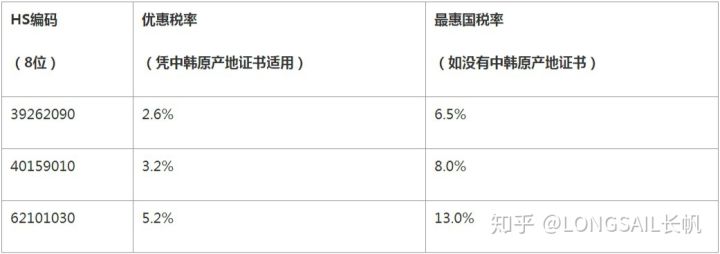
原產地優惠
中國已經和25個國家或地區簽署了17個自由貿易協定,中國原產的商品,包括疫情防控物資,出口到這些國家和地區憑優惠原產地證書可以獲得關稅減免優惠。
以出口防護服到韓國為例,可以看到關稅減免的幅度是很大的,所以建議出口前向海關申請原產地證書。
疫情防控需要的防護服出口涉及的公司資質證明材料與出口口罩基本相同。
產品準入條件
美國
必須要取得美國食品和藥物管理局FDA注冊認證才可以在美國本土市場進行銷售。
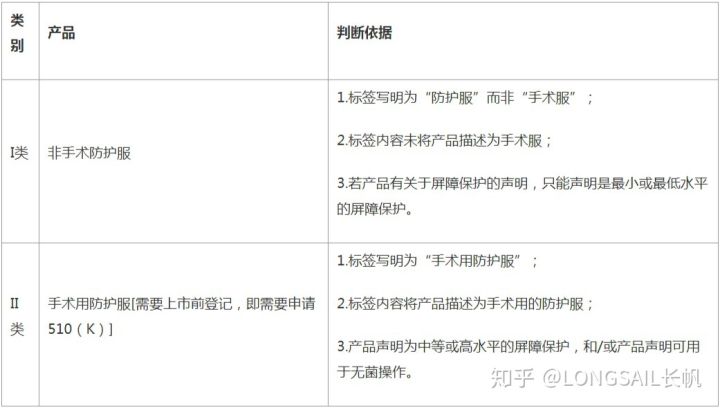
防護服分類:
美國醫用防護服可分為非手術防護服和手術用防護服兩類。非手術防護服屬于I類醫療器械,免于上市前登記,直接進行機構注冊。而手術用防護服屬于II類醫療器械,需要進行上市前登記,即需要申請FDA 510(K)。I類和II類醫用防護服的判斷依據見下表。
醫用防護服分類及判斷依據
2004年,FDA認可了美國國家標準學會/美國醫療器械促進協會標準ANSI/AAMI PB70《醫療保健設施中使用的防護服和防護布的液體阻擋層性能和分類》。企業申請上市前登記,一般都需要根據ANSI/AAMI PB70對防護服進行性能測試。
歐盟
須獲得歐盟CE認證,并符合技術法規:(EU)2016/425
2016年3月9日,歐盟通過了個人防護裝備(PPE)法規(EU) 2016/425,該法規撤銷并替代了PPE指令89/686/EEC,于2018年4月21日正式實施,并指出2019年4月21日之后投放市場的產品必須滿足(EU)2016/425中所有的要求,該法規覆蓋防護服、呼吸防護設備、手套等防護產品的安全監管。此期限,出口外貿企業和生產企業須重點注意。
根據法規(EU)2016/425第8條,出口歐盟的防護服制造商需要:
● 確保其產品符合法規附件Ⅱ列出的基本健康及安全要求;
● 撰寫法規附件Ⅲ所述的技術文件;
● 進行適用的合規評估程序;
● 撰寫歐盟合規聲明;
● 按照法規在產品貼附CE標記;
● 在個人保護裝備標明制造商的名稱、注冊商號或注冊商標、地址等;
● 確保個人保護裝備附有類型、批次或序列編號,以便識別;
● 撰寫使用說明,與個人防護裝備一并提供。說明書必須包含制造商的名稱及地址,以及可以連接到歐盟合規聲明的互聯網址。若歐盟合規聲明是隨個人防護裝備附上,說明書則無需包含互聯網址。
個人防護裝備投放市場后10年內,制造商必須保存其技術文件及歐盟合規聲明。
日本
如果需要投放市場產品必須滿足日本的Pharmaceutical and Medical Device Act (PMD Act),在PMD Act的要求下,TOROKU注冊系統要求國外的制造商必須向PMDA注冊制造商信息。
日本的政府機構主要是制定法律法規和進行宏觀管理,具體業務工作很多都交給各類行業協會來做。防護服涉及的主要行業協會為日本安全設備協會(JSAA)和日本防護服協議會(JPCA)。
● 日本安全設備協會(JSAA)網址:
公益社団法人 日本保安用品協會
jsaa.or.jp
● 日本防護服協議會(JPCA)網址:
日本防護服協議會?
bougofuku.net
● 日本醫藥品和醫療器械綜合機構(PMDA)網址:
獨立行政法人 醫薬品醫療機器総合機構
www.pmda.go.jp
韓國
韓國醫療器械準入的法規門檻,基本分類為I、II、III、IV類,持證為韓國公司(License holder),韓國收貨人需要到韓國藥監局Korea Pharmaceutical Traders Association.
提前備案進口資質(沒有不行)
??????????
www.kpta.or.kr
2020年1月15日,韓國勞動部2020-35號公告《防護設備安全認證通知》內給出了化學物質防護服、防塵口罩等性能標準和測試方法。根據《防護設備安全認證通知》內的防護服性能標準內容,防護服共分為六大類(其中第一類又分為5小類),類別見下表:

澳大利亞
須通過澳洲的TGA注冊,TGA 是Therapeutic Goods Administration的簡寫,全稱是治療商品管理局。澳大利亞對醫療器械分為I類,Is and Im, IIa, IIb, III類,分別為豁免、備案和注冊。無論哪類醫療器械,其上市銷售前必須得到澳大利亞政府的準許,符合醫療器械的基本要求,按照符合性審查程序進行審查。
特別提醒:澳大利亞已與歐盟達成互認協議。這意味著,合格評定證書由TGA頒發的也被歐盟認可,TGA也認可歐盟CE認證。已獲CE認證的用戶,可提交CE證書及相關資料,獲得TGA證書。
如果產品已經注冊或備案,制造商更換經銷商對其沒有影響。對國外產品進行注冊審批后,每年還要常規注冊一次,說明產品型號、性能及質量有無變化。TGA 全權負責對醫療器械的符合性評價,并收取一定費用,相關費用金額可參見 TGA的網站。
● 澳大利亞治療商品管理局(TGA)官網網址:
Therapeutic Goods Administration (TGA)
www.tga.gov.au
● 2002年《醫療器械法規》下載鏈接:
Federal Register of Legislation - Australian Government
www.legislation.gov.au
出口日本、韓國、澳大利亞醫用防護服注冊、認證流程與醫用口罩相同。
版權與免責聲明:此稿件為引述消息報道,稿件版權歸原作者所有,Landbridge平臺不對本稿件內容真實性負責。如發現政治性、事實性、技術性差錯和版權方面的問題及不良信息,請及時與我們聯系,并提供稿件的【糾錯信息】。糾錯熱線:0518-85806682

Landbridge平臺常務理事單位
- [常務理事單位] 沈陽陸橋國際貨運代理有限公司
- [常務理事單位] 湖南中南國際陸港有限公司
- [常務理事單位] 成都厚鯨集裝箱租賃有限公司
- [常務理事單位] 湖南德裕物流有限公司
- [常務理事單位] 安德龍國際物流集團
- [常務理事單位] 重慶逆鋒國際貨運代理有限公司
- [常務理事單位] 陜西遠韜供應鏈管理有限公司
- [常務理事單位] 天津海鐵聯捷集團有限公司
- [常務理事單位] LLC ST GROUP
- [常務理事單位] 宏圖集裝箱服務有限公司
- [常務理事單位] 哈薩克斯坦Falcon
- [常務理事單位] 青島和泰源集裝箱堆場
- [常務理事單位] 俄羅斯戰艦國際貨運代理有限公司
- [常務理事單位] 青島亞華集裝箱堆場
- [常務理事單位] 海晟(上海)供應鏈管理有限公司
- [常務理事單位] 俄羅斯西格瑪有限責任公司





